Dott. Giannantonio Spena
Direttore UOC Neurochirurgia
Fondazione IRCCS Policlinico San Matteo
Pavia
Fondazione IRCCS Policlinico San Matteo
Pad. Nuovo Ospedale "DEA"
Piano +7 - Corpo A
Segreteria 0382.502780
Per Appuntamento Ambulatoriale in Libera Professione Intramoenia
- Policlinico San Matteo: può prenotare al numero 0382.501788 oppure compilare il form on line
- Poliambulatorio Akesis viale Libertà 4, Pavia
0382.302996

I gliomi cerebrali sono tumori rari e molto eterogenei che originano dalle cellule costituenti la corteccia cerebrale e la sostanza bianca.
Per loro natura tendono ad infiltrare il cervello confondendosi con esso, sebbene talvolta sia possibile distinguerli nettamente dal cervello sano. Questo loro comportamento infiltrativo rende l'asportazione chirurgica particolarmente complessa e raramente la chirurgia può assicurare la guarigione. In più, i gliomi hanno tendenza ad infiltrare aree del cervello fondamentali per l'espressione verbale, la lettura, la scrittura, la coordinazione motoria e la sensibilità del corpo.
Classicamente alcune aree del cervello vengono definite "eloquenti" (cioè altamente funzionali) mentre altre non eloquenti. Di fatto tutte le aree del cervello sono funzionali la differenza è che alcuni epicentri funzionano come terminali sui quali afferiscono miriadi di connessioni e pertanto una lesione ad uno di questi epicentri può generare disturbi neurologici difficilmente recuperabili. Altri epicentri sono meno interconnessi e comunque la loro funzione può essere in tempo breve o più lungo presa in carico da altri epicentri.
Altra caratteristica cruciale dei gliomi è l'ampia differenza che esiste nella velocità di crescita. Alcuni crescono in maniera lentissima senza di fatto alterare le funzioni cerebrali del paziente che (molto frequentemente) arriva ad accorgersi di avere un glioma solo quando questo raggiunge dimensioni ragguardevoli (vedi immagini qui sotto). Quando invece la velocità di crescita è alta, è più probabile che il paziente presenti dei disturbi legati al malfunzionamento dell'area del cervello irritata dalla presenza del tumore.
Uno dei principali obbiettivi della neurochirurgia è quello di effettuare una asportazione quanto più ampia possibile minimizzando il danno delle funzioni cerebrali. E' stato infatti ampiamente dimostrato che l'estensione della asportazione correla con il prolungamento della sopravvivenza.
Poichè la variabilità anatomica e la distribuzione delle funzioni nella corteccia e sostanza bianca è enorme tra soggetto e soggetto è impossibile prevedere con assoluta precisione se una zona infiltrata dal tumore sia asportabile e in che misura la sua asportazione produrra dei disturbi neurologici permanenti.
Fortunatamente oggigiorno esistono tecnologie diagnostiche che permettono di visualizzare l'attività di una particolare zona del cervello e capire se essa è implicata in una specifica funzione. L’esame più utilizzato a tale scopo è la Risonanza Magnetica Funzionale che consente di visualizzare sotto forma di "macchie" di differenti colori le zone di corteccia cerebrale che si attivano mentre il soggetto esegue dei compiti.
Allo stesso modo ma con tecniche diverse è possibile ricostruire un modello delle connessioni tra neuroni (almeno i fasci di dimensioni più grandi). Esistono delle sequenze della RM che sfruttano la diffusione delle molecole di acqua lungo le connessioni cerebrali e riproducono immagini 3D di grande affidabilità che possono aiutare il chirurgo nel comprendere i rapporti tra tumore ed fasci di sostanza bianca.
Nonostante questi enormi passi avanti della neuroradiologia esistono ancora molti limiti che non consentono al chirurgo di affidarsi unicamente a queste metodiche per operare tumori cerebrali in aree critiche.
Per questo al giorno d'oggi il Brain Mapping mediante stimolazione cerebrale diretta a paziente sveglio ed il Monitoring sono diventati il gold standard per la chirurgia dei tumori cerebrali in aree critiche.
Lo scopo di applicare una corrente elettrica non deleteria sulla cortceccia cerebrale e nella sostanza bianca, è quello di eccitare o inibire dei gruppi di neuroni e quinid provocare per alcuni secondi un corto circuito in modo da simulare cosa accadrebbe se venissero asportati. Così facendo si viene a disegnare una mappa delle funzioni presenti nell'area del cervello esposta.
Attraverso questa tecnica è possibile analizzare molte funzioni cerebrali come quella sensitiva, il linguaggio verbale, la scrittura, la lettura, il calcolo, la visione.
Le aree sensitive e motorie possono essere mappate anche con il paziente addormentato. La scelta su che tipo di tecnica utilizzare viene discussa con il chirurgo caso per caso. Al contrario, il mappaggio delle altre funzioni sopracitate necessita della completa collaborazione del paziente durante l'intervento chirurgico.
GLIOMI CEREBRALI
Links utili
Classificazione dei tumori cerebrali
secondo l'Organizzazione Mondiale della Sanita (WHO 2021)
Approfondimento
Cenni storici
La prima descrizione della stimolazione cerebrale diretta in neurochirurgia è stata ttribuita a Victor Horsley and David Ferrier nel 1884 seguita da William Keen nel 1888, Leonard Bidwell e Charles Sherrington nel maggio 1893 e Fedor Krause nel novembre 1893.
Di fatto, Wilder Penfield è stato il pioniere del mapping cerebrale diretto a paziente cosciente con lo scopo di preservare aree eloquenti.Grazie a questa tecnica Penfield riuscì a descrivere l'organizzazione delle aree motorie e sensitive della corteccia cerebrale. Negli anni '70 la tecnica è stata perfezionata da Geroge Ojemann che ha introdotto la corrente bifasica a pulsazione costante; egli ha inoltre migliorato la tipologia di test del linguaggio intraoperatori. Negli anni '90 Mitchel Berger ha applicato questa tecnica ai fini di neurochirurgia oncologica ed inoltre è stato il primo ad applicare la stimolazione anche ai fasci di sostanza bianca (tratto cortico-spinale). Di seguito Hugues Duffau ha esteso e codificato le indicazioni alla stimolazione cerebrale diretta corticale e sottocorticale. La tecnica consisteva (ed è ancora cosi) nell'applicare una corrente mediante un elettrodo bipolare sulla corteccia cerebrale.
In seguito sono state sviluppate anche altre tecniche di stimolazione (come la monopolare) ed anche sistemi per monitorare gli effetti della stimolazione.
Per approfondire l'argomento clicca qui
oppure clicca qui.
Esempi clinici

Risonanza Magnetica funzionale
Si noti come la corteccia frontale ed in parte quella temporale si illuminino (aree arancio/gialle) attorno al tumore (area grigio scuro). Durante la RM il paziente eseguiva un test di fluenza verbale
Risonanza Magnetica con DTI fiber tracking
Questa sequenza di RM permette di ricostruire un modello dei fasci di sostanza bianca (cioè le connessioni tra i neuroni)




Alcune immagini di interventi chirurgici eseguiti con mapping a paziente sveglio
La corrente elettrica per eseguire la stimolazione cerebrale ed il mappaggio viene applicata mediante un elettrodo bipolare. Il paziente è in grado di eseguire diversi compiti come leggere, scrivere, contare, ripetere parole e così via. Le piccole etichette bianche numerate servono a creare la mappa della zona di cervello sulla quale è stata applicata la corrente di stimolazione.
Asportazione di un voluminoso glioma a lento accrescimento fronto-temporo-insulare destro (monitoraggio elettrofisiologico)

Glioma a lento accrescimento
In basso a sinistra è presentata la RM di un paziente affetto da un voluminoso glioma a lento accrescimento che infiltra la corteccia frontale mesiale insieme al cingolo ed al corpo calloso. Il paziente conduceva una vita del tutto normale e soltanto una crisi epilettica lo condusse in ospedale. I test neuropsicologici rilevarono un funzionamento globale nella norma con solo qualche problema di memoria. A destra vi è la RM postoperatoria che dimostra l'asportazione totale della massa; il paziente ha potuto riprendere completamente le sue attività quotidiane nel giro di 6 settimane. A distanza di 2 anni non ha presentato altri attacchi epilettici.



L'importanza dell'awake surgery e dei monitoraggi elettrofisiologici
La neurochirurgia dei tumori localizzati in aree eloquenti necessita di tecniche e tecnologie in grado di guidare il chirurgo durante la resezione, evidenziando la presenza di aree deputate a funzioni neurologiche all'interno o in contiguità con la massa tumorale.
Qui di seguito si riporta il caso di un paziente operato precedentemente in un altro centro per asportazione di un glioma in area supplementare motoria, molto vicino alle zone che controllano i movimenti del corpo. Poiché la chirurgia era stata effettuata senza l'ausilio delle tecniche discusse sopra, il tumore era stato solo in parte rimosso. Il paziente inoltre continuava a soffrire di numerose crisi epilettiche a frequenza settimanale.
Si decideva quindi di rioperarlo mediante una chirurgia a paziente sveglio e mappaggio delle funzioni corticali e sottocorticali. L'asportazione era totale ed il paziente aveva un immediato beneficio sulle crisi epilettiche.

* le aree bordate di verde rappresentano il residuo di tumore non asportato durante la prima chirurgia. Le immagini inferiori mostrano la resezione completa.

L'importanza dell'awake surgery e dei monitoraggi elettrofisiologici
Anche nel caso riportato qui sotto l'awake surgery è stata fondamentale. Questa giovane donna aveva avuto diverse crisi epilettiche che l'avevano portata alla diagnosi di neoplasia del lobo frontale. A parte le crisi, la paziente era integra e conduceva una vita normale. E' stata operata in anestesia locale con mapping delle funzioni cognitive ottenendo un'asportazione totale. La diagnosi era di astrocitoma WHO II (IDH1 wt, no LOH1p19q). Ha eseguito una radioterapia e dopo tre anni e mezzo la paziente conduce una vita normale senza più crisi epilettiche e al momento non vi è nessun segno di ritorno di malattia



Qui di seguito viene riportato il caso di un giovane paziente operato 4 anni prima per un astrocitoma frontale sinistro presso un altro istituto. L'asportazione del tumore non era completa. Il paziente continuava a soffrire di crisi epilettiche e le RM di controllo mostravano un incremento del residuo di tumore. Era quindi sottoposto ad un intervento in awake surgery con mappaggio di differenti funzioni del linguaggio. A destra si vede la RM postoperatoria che conferma l'asportazione totale.



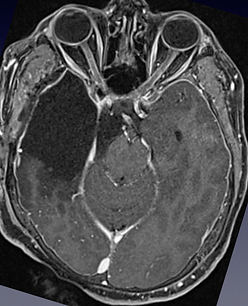
Il caso riportato qui sotto si riferisce ad un giovane adulto con una neoplasia (glioma della linea mediana H3K27M). Il tumore infiltrava la porzione posteriore (pulvinar) del talamo di destra. L'intervento chirurgico era eseguito con monitoraggio elettrofisiologico (SEP e PEM transcranici; strip corticale per PEM). L'asportazione era completa senza alcun deficit postoperatorio

Paziente giunta in PS per stato confusionale e sopore. Nella foto di sinistra si vede la RM preoperatoria che dimostra la presenza di una voluminoso sospetto glioma che infiltra il lobo temporale destro e invade la cisterna ambiens e crurale. La paziente è stata operata d'urgenza per asportazione completa della massa con ausilio di monitoraggio elettrofisiologico. A destra la RM postoperatoria che conferma la resezione totale. La diagnosi è stata di astrocitoma IDH 1 wild type.